食品药品监管局通报欣弗药品不良事件调查结果
2006/8/21 11:19:17作者:* 摘自:新浪网 编辑:白海燕
文字显示大小选择:【 】
食品药品监管局通报欣弗药品不良事件调查结果
8月4日拍摄的安徽华源生物药业有限公司厂区外景。
8月4日拍摄的被山东省蓬莱市食品药品监督管理局查封的一批“克林霉素磷酸酯葡萄糖注射液”。
相关多媒体音视频内容
2006年8月15日,国家食品药品监督管理局召开新闻发布会,通报了对安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)引发的药品不良事件调查结果:现已查明,安徽华源生物药业有限公司违反规定生产,是导致这起不良事件的主要原因。
国家食品药品监督管理局会同安徽省食品药品监督管理局对安徽华源生物药业有限公司进行现场检查。经查,该公司2006年6月至7月生产的克林霉素磷酸酯葡萄糖注射液未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果。经中国药品生物制品检定所对相关样品进行检验,结果表明,无菌检查和热原检查不符合规定。
这次不良事件发生后,药品监管部门采取了果断的控制措施,开展了全国范围拉网式检查,尽全力查控和收回所涉药品。经查,安徽华源生物药业有限公司自2006年6月份以来共生产该产品3701120瓶,售出3186192瓶,流向全国26个省份。除未售出的484700瓶已被封存外,截至8月14日13点,企业已收回1247574瓶,收回途中173007瓶,异地查封403170瓶。
国家食品药品监督管理局责成安徽省食品药品监督管理局对安徽华源生物药业有限公司的违法违规行为依法做出处理,并追究相关责任人的责任。各级药品监管部门将进一步配合卫生部门积极做好患者的救治工作。
为切实保障公众用药安全,国家食品药品监督管理局再次强调,药品生产企业必须建立健全质量保证体系,必须保证每个环节按照标准操作规程执行,必须对原辅料的购入、检验、使用等严格管理,必须严格按照法定标准、批准工艺组织生产,必须建立真实的药品生产记录和销售记录,必须保证产品检验合格后审核放行,确保药品生产质量。 >>>详细
相关报道:
欣弗事件初步认定 华源未按批准工艺进行生产每周质量报告:夺命注射液悬疑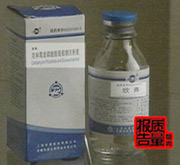
国家药监局新闻发言人张冀湘:企业未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致药品集中出现不良反应事件的原因,药品检验工作正按程序进行,对不良事件的报告病历,与药品之间的关联性评价工作正加紧进行。详细>>>
新华网北京8月10日电(记者张晓松)国家食品药品监督管理局初步分析认定,安徽华源生物药业有限公司未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致克林霉素磷酸酯葡萄糖注射液(欣弗)集中出现不良事件的原因。目前,药品检验工作正按程序进行,对不良事件的报告病例与药品之间的关联性评价工作也正在加紧进行。 >>>详细
走访"欣弗"制造源:安徽华源及地方主管说"欣弗"
8月10日,国家食品药品监督管理局通报了对安徽华源事件调查进展:国家食品药品监督管理局会同安徽省食品药品监督管理局对安徽华源生物药业有限公司进行现场检查,经对2006年6月至7月份所生产的克林霉素磷酸酯葡萄糖注射液的生产过程核查,初步分析认定,企业未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致药品集中出现不良事件的原因。
尽管这一结论还只是一个“初步分析认定”,但对于沸沸扬扬的欣弗事件至少有了一个结论性的说法,因为在此之前,关于欣弗事件到底根在何处,包括当事者在内的各方都有不同说法。 >>>详细
食品药品监管局通报欣弗药品不良事件调查结果
8月4日拍摄的安徽华源生物药业有限公司厂区外景。
 |
8月4日拍摄的被山东省蓬莱市食品药品监督管理局查封的一批“克林霉素磷酸酯葡萄糖注射液”。
相关多媒体音视频内容
 |
 |
2006年8月15日,国家食品药品监督管理局召开新闻发布会,通报了对安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)引发的药品不良事件调查结果:现已查明,安徽华源生物药业有限公司违反规定生产,是导致这起不良事件的主要原因。
国家食品药品监督管理局会同安徽省食品药品监督管理局对安徽华源生物药业有限公司进行现场检查。经查,该公司2006年6月至7月生产的克林霉素磷酸酯葡萄糖注射液未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果。经中国药品生物制品检定所对相关样品进行检验,结果表明,无菌检查和热原检查不符合规定。
这次不良事件发生后,药品监管部门采取了果断的控制措施,开展了全国范围拉网式检查,尽全力查控和收回所涉药品。经查,安徽华源生物药业有限公司自2006年6月份以来共生产该产品3701120瓶,售出3186192瓶,流向全国26个省份。除未售出的484700瓶已被封存外,截至8月14日13点,企业已收回1247574瓶,收回途中173007瓶,异地查封403170瓶。
国家食品药品监督管理局责成安徽省食品药品监督管理局对安徽华源生物药业有限公司的违法违规行为依法做出处理,并追究相关责任人的责任。各级药品监管部门将进一步配合卫生部门积极做好患者的救治工作。
为切实保障公众用药安全,国家食品药品监督管理局再次强调,药品生产企业必须建立健全质量保证体系,必须保证每个环节按照标准操作规程执行,必须对原辅料的购入、检验、使用等严格管理,必须严格按照法定标准、批准工艺组织生产,必须建立真实的药品生产记录和销售记录,必须保证产品检验合格后审核放行,确保药品生产质量。 >>>详细
相关报道:
欣弗事件初步认定 华源未按批准工艺进行生产每周质量报告:夺命注射液悬疑

国家药监局新闻发言人张冀湘:企业未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致药品集中出现不良反应事件的原因,药品检验工作正按程序进行,对不良事件的报告病历,与药品之间的关联性评价工作正加紧进行。详细>>>
新华网北京8月10日电(记者张晓松)国家食品药品监督管理局初步分析认定,安徽华源生物药业有限公司未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致克林霉素磷酸酯葡萄糖注射液(欣弗)集中出现不良事件的原因。目前,药品检验工作正按程序进行,对不良事件的报告病例与药品之间的关联性评价工作也正在加紧进行。 >>>详细
走访"欣弗"制造源:安徽华源及地方主管说"欣弗"
8月10日,国家食品药品监督管理局通报了对安徽华源事件调查进展:国家食品药品监督管理局会同安徽省食品药品监督管理局对安徽华源生物药业有限公司进行现场检查,经对2006年6月至7月份所生产的克林霉素磷酸酯葡萄糖注射液的生产过程核查,初步分析认定,企业未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致药品集中出现不良事件的原因。
尽管这一结论还只是一个“初步分析认定”,但对于沸沸扬扬的欣弗事件至少有了一个结论性的说法,因为在此之前,关于欣弗事件到底根在何处,包括当事者在内的各方都有不同说法。 >>>详细
食品药品监管局通报欣弗药品不良事件调查结果
本文关键词:食品药品监管局,欣弗药品不良事件,调查结果
本文已经被阅读了:4021次
本文已经被阅读了:4021次
→ 读者评论意见:
- 3294:小学英语评课稿:https://www.nanss.com/gongzuo/zt/xxyypkg21259.html 优秀教师简介:https://www.nanss.com/xuexi/zt/yxjsjj21484.html 新学期工作计划:https://www.nanss.com/gongzuo/zhuanti/20900.html 年月日说课稿:https://www.nanss.com/gongzuo/zt/nyrskg21451.html
- 2210:阳光的网名:http://www.nanss.com/mingcheng/7522.html 学期个人总结:http://www.nanss.com/xuexi/7831.html qq伤感网名:http://www.nanss.com/mingcheng/7793.html 期中小结:http://www.nanss.com/xuexi/8254.html
- fuxxwuh:-堑钡壕按我https://www.imdb.com/list/ls571756562/?mode=desktop&ref_=h_tv_f
→ 请发表您的评论:
→ 相关文章:




 位来访者 本站累计浏览:
位来访者 本站累计浏览: